Jika Anda pernah mempelajari tabel unsur secara periodik (lihat di bawah), Anda mungkin sudah menyadari bahwa tabel ini mengungkapkan banyak hal tentang sifat kimiawi atom yang membentuk dunia kita.
Tetapi Anda mungkin tidak menyadari bahwa setiap kotak pada tabel periodik sebenarnya mewakili keluarga isotop – atom yang memiliki nama dan sifat kimia yang sama, tetapi memiliki massa yang berbeda.
Untuk memahami apa isotop itu dan bagaimana kita dapat menggunakannya, kita perlu melihat lebih dekat pada bagian dalam atom.
Blok bangunan materi
Sebuah atom terdiri dari inti yang sangat padat (disebut nukleus) proton dan neutron, dikelilingi oleh awan elektron yang tersebar.
Anda dapat menganggap proton dan neutron sebagai jenis partikel yang sama dengan satu perbedaan utama: proton bermuatan positif, sedangkan neutron tidak membawa muatan. Ini berarti proton dapat “merasakan” medan listrik atau magnet, sementara neutron tidak bisa.
Elektron, yang jauh lebih ringan dari proton atau neutron, membawa muatan yang sama besarnya dengan proton tetapi dengan tanda yang berlawanan, artinya setiap atom yang memiliki jumlah proton dan elektron yang sama adalah netral secara elektrik.
Ini adalah elektron yang menentukan perilaku kimia unsur tertentu.
Isotop suatu unsur memiliki jumlah proton yang sama tetapi memiliki jumlah neutron yang berbeda. Mari kita gunakan karbon sebagai contoh.
Ada tiga isotop karbon yang ditemukan di alam – karbon-12, karbon-13, dan karbon-14. Ketiganya memiliki enam proton, tetapi nomor neutronnya – 6, 7, dan 8, masing-masing – semuanya berbeda. Ini berarti bahwa ketiga isotop memiliki massa atom yang berbeda (karbon-14 adalah yang terberat), tetapi memiliki nomor atom yang sama (Z = 6).
Secara kimia, ketiganya tidak bisa dibedakan, karena jumlah elektron di masing-masing dari ketiga isotop adalah sama.
Jadi isotop yang berbeda dari unsur yang sama identik, secara kimiawi. Tetapi beberapa isotop memiliki kemampuan untuk menghindari aturan ini dengan mentransformasikannya menjadi elemen lain sepenuhnya.
Berbaris menuju stabilitas
Kemampuan transformatif ini ada hubungannya dengan fakta bahwa tidak semua isotop stabil, dan inilah yang membuat Frederick Soddy menemukan penemuan isotop pemenang Hadiah Nobel pada 1913.
Beberapa isotop – seperti karbon-12 – akan dengan senang hati terus eksis sebagai karbon kecuali sesuatu yang luar biasa terjadi. Lainnya – karbon-14, katakanlah – pada beberapa titik akan membusuk menjadi isotop stabil di dekatnya.
Dalam hal ini, salah satu neutron dalam karbon-14 berubah menjadi proton, membentuk nitrogen-14. Selama proses ini, yang dikenal sebagai peluruhan beta, inti memancarkan radiasi dalam bentuk elektron dan antineutrino.
Ada banyak faktor yang dapat menyebabkan nukleus membusuk. Salah satu yang paling penting adalah rasio proton terhadap neutron yang dimiliki nukleus tertentu. Jika nukleus memiliki terlalu banyak neutron (definisi “terlalu banyak” tergantung pada seberapa berat nukleusnya), ada kemungkinan ia akan membusuk menuju stabilitas.
Hal yang sama berlaku jika nukleus memiliki terlalu banyak proton. Ini adalah salah satu alasan mengapa beberapa isotop unsur tertentu bersifat radioaktif, sementara yang lain tidak.
Apa itu Isotop
Isotop adalah bentuk dari unsur yang nukleusnya memiliki nomor atom yang sama,tetapi jumlah proton di nukleus dengan massa atom yang berbeda karena mereka memiliki jumlah neutron yang berbeda.
Kata isotop, berarti di tempat yang sama, berasal dari fakta bahwa seluruh isotop dari sebuah unsur – unsur terletak di tempat yang sama dalam tabel periodik.
Secara bersama, isotop-isotop dari unsur-unsur membentuk suatu set nuklida. Sebuah nuklida adalah satu jenis tertentu nukleus atom, atau lebih umum sebuah aglomerasi proton dan neutron. Lebih tepat lagi untuk mengatakan bahwa sebuah unsur seperti fluorine terdiri dari satu nuklida stabil dan bukan dia memiliki satu isotop stabil.
Dalam nomenklatur ilmiah, isotop (nuklida) dispesifikasikan berdasarkan nama unsur tertentu oleh sebuah hyphen dan jumlah nukleon (proton dan neutron) dalam nukleus atom (misal, helium-3, karbon-12, karbon-14, besi-57, uranium-238). Dalam bentuk simbolik, jumlah nukleon ditandakan sebagai sebuah prefik naik-ke-atas terhadap simbol kimia (misal, 3He, 12C, 14C, 57Fe, 238U, dan lain-.lain).
Semua atom dari unsur yang sama memiliki jumlah proton yang sama, tetapi beberapa mungkin memiliki jumlah neutron yang berbeda. Sebagai contoh, semua atom karbon memiliki enam proton, dan sebagian besar memiliki enam neutron juga. Tetapi beberapa atom karbon memiliki tujuh atau delapan neutron bukannya enam.
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Banyak isotop terjadi secara alami. Biasanya satu atau dua isotop dari suatu unsur yang paling stabil dan umum. Isotop yang berbeda dari unsur umumnya memiliki sifat fisik dan kimia yang sama.
Pengertian Isotop
Isotop adalah bentuk dari unsur yang nukleusnya memiliki nomor atom yang sama,tetapi jumlah proton di nukleus dengan massa atom yang berbeda karena mereka memiliki jumlah neutron yang berbeda.
Kata isotop, berarti di tempat yang sama, berasal dari fakta bahwa seluruh isotop dari sebuah unsur – unsur terletak di tempat yang sama dalam tabel periodik.
Secara bersama, isotop-isotop dari unsur-unsur membentuk suatu set nuklida. Sebuah nuklida adalah satu jenis tertentu nukleus atom, atau lebih umum sebuah aglomerasi proton dan neutron. Lebih tepat lagi untuk mengatakan bahwa sebuah unsur seperti fluorine terdiri dari satu nuklida stabil dan bukan dia memiliki satu isotop stabil.
Dalam nomenklatur ilmiah, isotop (nuklida) dispesifikasikan berdasarkan nama unsur tertentu oleh sebuah hyphen dan jumlah nukleon (proton dan neutron) dalam nukleus atom (misal, helium-3, karbon-12, karbon-14, besi-57, uranium-238). Dalam bentuk simbolik, jumlah nukleon ditandakan sebagai sebuah prefik naik-ke-atas terhadap simbol kimia (misal, 3He, 12C, 14C, 57Fe, 238U, dan lain-.lain).
Semua atom dari unsur yang sama memiliki jumlah proton yang sama, tetapi beberapa mungkin memiliki jumlah neutron yang berbeda. Sebagai contoh, semua atom karbon memiliki enam proton, dan sebagian besar memiliki enam neutron juga. Tetapi beberapa atom karbon memiliki tujuh atau delapan neutron bukannya enam.
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Banyak isotop terjadi secara alami. Biasanya satu atau dua isotop dari suatu unsur yang paling stabil dan umum. Isotop yang berbeda dari unsur umumnya memiliki sifat fisik dan kimia yang sama. Itu karena mereka memiliki jumlah yang sama dari proton dan elektron. Untuk penjelasan video tentang isotop, kunjungi URL ini:
Contoh Isotop
Hidrogen adalah contoh dari unsur yang memiliki isotop. Tiga isotop hidrogen dimodelkan pada Gambar di bawah. Kebanyakan atom hidrogen hanya memiliki satu proton dan satu elektron dan tidak memiliki neutron. Atom-atom ini hanya disebut hidrogen. Beberapa atom hidrogen memiliki satu neutron juga. Atom-atom ini adalah isotop bernama deuterium. Atom hidrogen lainnya memiliki dua neutron. Atom-atom ini adalah isotop bernama tritium. Untuk versi animasi dari isotop hidrogen ini, lihat ke URL ini:
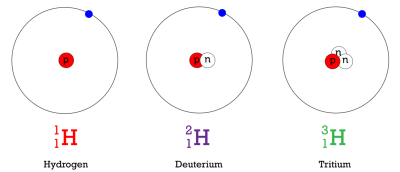
Q: Jumlah massa atom adalah jumlah proton dan neutron. Berapa jumlah massa masing-masing isotop hidrogen yang ditunjukkan pada Gambar di atas?
A: nomor massa: hidrogen = 1, deuterium = 2, dan tritium = 3.
Penamaan Isotop
Bagi sebagian besar unsur selain hidrogen, isotop diberi nama sesuai nomor massa mereka. Misalnya, atom karbon dengan 6 neutron memiliki nomor massa 12 (6 proton + 6 neutron = 12), sehingga mereka disebut karbon-12. Atom karbon dengan 7 neutron memiliki massa atom 13 (6 proton + 7 neutron = 13). Atom-atom ini adalah isotop yang disebut karbon-13.
Q: Beberapa atom karbon memiliki 8 neutron. Apa nama isotop karbon ini?
A: atom karbon dengan 8 neutron memiliki massa atom 14 (6 proton + 8 neutron = 14), sehingga isotop karbon ini diberi nama karbon-14.
Stabilitas Isotop
Atom membutuhkan rasio neutron dan proton tertentu sehingga memiliki inti yang stabil. Memiliki terlalu banyak atau terlalu sedikit neutron relatif terhadap jumlah proton menghasilkan ketidak stabilan, atau radioaktif, sehingga inti cepat atau lambat akan terpecah ke bentuk yang lebih stabil. Proses ini disebut peluruhan radioaktif.
Banyak isotop memiliki inti radioaktif, dan isotop ini disebut sebagai radioisotop. Ketika mereka meluruh, mereka merilis partikel yang mungkin berbahaya. Inilah sebabnya mengapa isotop radioaktif yang berbahaya dan mengapa bekerja dengan mereka membutuhkan pakaian khusus untuk perlindungan. Isotop karbon dikenal sebagai karbon-14 adalah contoh radioisotop. Sebaliknya, isotop karbon yang disebut karbon-12 dan karbon-13 yang stabil.
Perbedaan Unsur, Atom dan Isotop
Pengertian Unsur adalah zat tunggal yang secara kimia tidak dapat diuraikan lagi menjadi zat lain yang lebih sederhana. Contohnya yaitu Hidrogen dan oksigen karena jenis gas tersebut tidak dapat diuraikan lagi menjadi zat yang lebih sederhana, lain halnya jika air dapat diuraikan oleh listrik mejadi dua jenis gas yaitu hidrogen dan oksigen.
Beberapa contoh unsure dalam kehidupan sehari-hari adalah besi, alumunium, timah, emas, tembaga, perak, oksigen, nitrogen, belerang dan karbon.
Unsur berdasarkan sifatnya dapat dibagi menjadi 3 macam yaitu:
1. Unsur-unsur logam.
2. Unsur-unsur non logam.
3. Unsur-unsur Semi logam (Metaloid).
Atom adalah bagian terkecil dari suatu unsur yang masih memiliki sifat unsur tersebut.
Setiap atom dari suatu unsur memiliki sifat tertentu yang berbeda dengan sifat atom unsur yang lain. Perbedaan ini meliputi sifat kimia dan sifat fisiknya.
Perbedaan antaratom terjadi karena perbedaan jumlah proton, elektron, dan neutron penyusunnya. Isotop adalah varian pada sebuah unsur yang memiliki berat atom yang berbeda dari varian lainnya. Kecuali untuk bentuk paling umum dari hidrogen – yang hanya memiliki proton – setiap inti atom dalam materi normal terdiri dari keduanya proton dan neutron.
Isotop dari unsur tertentu memiliki jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Mereka memiliki dasarnya sifat kimia yang sama, namun sedikit berbeda dalam karakteristik fisik mereka, seperti titik leleh dan titik didih.
Ringkasan
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Isotop yang berbeda dari unsur umumnya memiliki sifat fisik dan kimia yang sama karena mereka memiliki nomor yang sama dari proton dan elektron.
Kebanyakan atom hidrogen kekurangan neutron dan hanya disebut hidrogen. Atom hidrogen dengan satu neutron adalah isotop yang dikenal sebagai deuterium, dan mereka isotop dengan dua neutron adalah bernama tritium.
Bagi sebagian besar unsur selain hidrogen, isotop diberi nama sesuai nomor massa mereka, yang merupakan jumlah proton ditambah neutron. Misalnya, karbon dengan nomor massa 14 disebut karbon-14.
Atom membutuhkan rasio tertentu antara neutron dan proton sehingga memiliki inti yang stabil. Jika mereka memiliki terlalu banyak atau terlalu sedikit neutron relatif terhadap proton, mereka merupakan radioaktif dan akan meluruh ke bentuk yang lebih stabil. Isotop dengan inti radioaktif disebut radioisotop.