Entalpi – Malam sobat apafungsi.com .! Semoga semua dalam keadaan baik ya. terlepas dari Corona! Materi kali ini akan mengulas tentang entalpi dalam topik ilmu kimia, yang akan apafungsi.com jabarkan secara rinci mulai dari dari pengertian, diagram, rumus dan contoh soalnya. Namun tentunya pembaca masih inget dipertemuan sebelumnya apafungsi.com juga telah menerangkan materi selain pengertian entalpi. Nah biar gak banyak basa basi bukan.!! Baiklah langsung aja simak ulasan dibawah ini
Pengertian Entalpi
Pengertian Entalpi adalah besaran termodinamika (selain volume dan tekanan) yang menyatakan jumlah energi dari suatu sistem termodinamika. Entalpi terdiri dari energi dalam sistem, termasuk satu dari lima potensial termodinamika dan fungsi keadaan, juga volume dan tekanannya (merupakan besaran makro).
Satuan SI dari entalpi ialah joule (disinkat J kapotal), namun digunakan juga satuan British thermal unit (disingkat BTU jangan dibaca batu) dan kalori. Total entalpi (H) tidak bisa diukur langsung dan memang kurang penting. Sama seperti pada mekanika klasik, hanya perubahan entalpi yang dapat dinilai.
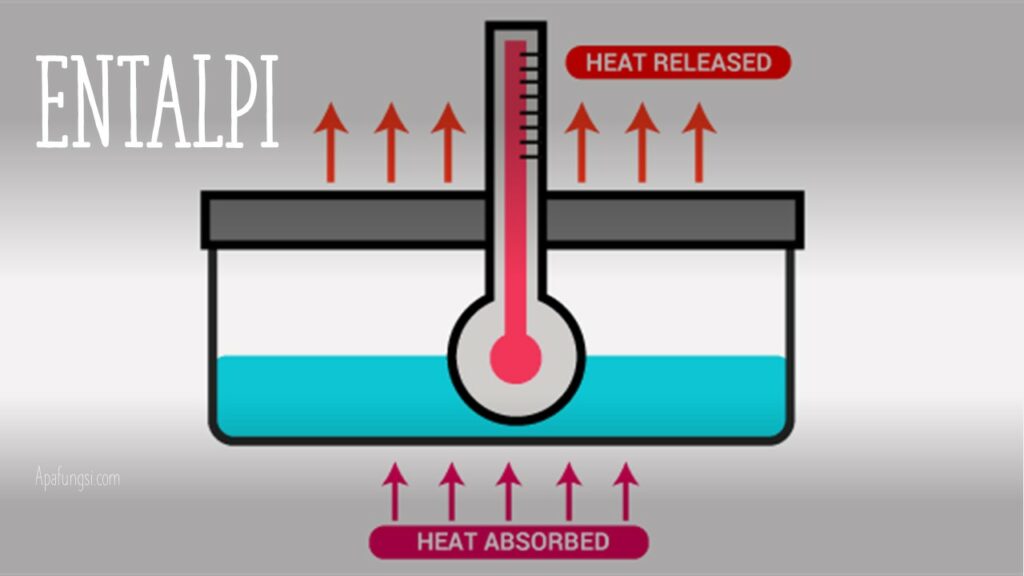
Pada sebuah proses tekanan konstan, perubahan entalpi atau ΔH sama dengan perubahan energi dalam sistem ditambah kerja yang dilakukan sistem pada lingkungannya.
Perubahan entalpi reaksi adalah ukuran perbedaan entalpi reaktan dan produk.
Maka, perubahan entalpi pada kondisi ini ialah kalor yang diambil atau dilepas melalui reaksi kimia atau perpindahan panas eksternal.
Entalpi suatu sistem ditentukan oleh energi yang dibutuhkan untuk memecah ikatan kimia dan energi yang diperlukan untuk membentuk ikatan kimia.
Maka kemudian pada entalpi gas ideal, solid, dan liquid tidak dipengaruhi tekanan. Entalpi sistem dinyatakan dalam persamaan berikut:
H=U+pV
Keterangan:
- H= entalpi sistem
- U= Energi dalam suatu sistem
- p=Tekanan sistem/dikeliling sistem
- V=Volume sisitem
Pengertian Entalpi juga dapat dikatan bahwa suatu sifat ekstensif (sifat makroskopis yang bergantung pada massa atau kuantitas zat) yang berarti untuk sistem homogen, yang kuantitasnya berbanding lurus dengan ukuran sistem. Tidak jarang yang dipakai ialah entalpi spesifik h =H/m dengan m ialah massa sistem, atau entalpi molar Hm = H/n, dengan n ialah jumlah mol, h dan Hm ialah sifat intensif (sifat makroskopis yang tidak tergantung pada massa sistem).
Entalpi H(S,p) dari suatu sistem homogen dapat diturunkan sebagai fungsi karakteristik S dan tekanan p sebagai berikut: hukum pertama termodinamika untuk sistem tertutup:
dU=δQ-δW,
Disini, δQ ialah sejumlah kecil panas (infinitesimal) yang ditambahkan dalam sistem dan δW ialah sejumlah usaha yang dilakukan sistem. Kemudian dalam homohen proses reversibel hanya dapat berlangsung pada hukum kedua termodinamika menyatakan δQ = TdS dengan T ialah temperatur absolut sistem. Apabila kerja PV yang ada, δW = pdV. Sehingga
dU=TdS-pdV.
Menambahkan d(pV) di kedua sisi sehingga menjadi
dU+d(pV)=TdS-pdV+d(pV)
atau
d(U+pV)=TdS+Vdp
maka
dH(S,p)=TdS+vdp.
Satuan Entalpi
Entalpi dinyatakan dalam bentuk energi per massa. Energi mempunyai satuan joule(J) dan massa mempunyai satuan kilogram(kg), dengan demikian, satuam entalpi iaah J/kg. Satuan entalpi yang lain ialah erg/gram;BTU/lbm;kal/gram;dsb.
Konversi satuan entalpi ialah berikut ini:
- 1Kal/gram=4184J/kg
- 1BTU/lbm=2326 J/kg.
Penentuan Entalpi Reaksi
Entalpi Reaksi ditentukan dengan cara memakai sebuah alat yang disebut kalorimeter (alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia.). Dalam kalorimeter zat yang akan direaksikan dimasukan kedalam tabung reaksi.
q larutan = m.c.∆T
q calorimeter = C. ∆T
Keterangan :
q : jumlah kalor
m : massa laruran
c : kalor jenis air atau larutan
C : kapasitas kalor
∆T : selisih kenaikan suhu
Jenis jenis Entalpi
Terdapat beberapa macam entalpi, yang sering digunakan yakni sebagi berikut:
- Entalpi Transisi
- Entalpi hidrasi
- Entapil Pembakaran
- Entalpi Netralisasi
- Entalpi sublimasi
- Entalpi Pembentukan
- Entalpi peruraian
- Entalpi Pelarutan
- Entalpi Penggabungan
- Entalpi Penguapan
Nilai Entalpi
Entalpi Posistip. Entalpi positip terjadi pada reaksi yang bersifat endoterm.
Entalpi Negatif. Entalpi yang bernilai negatif mengindikasikan bahwa reaksi berlansung secara eksoterm.
Entalpi Kisi. Ketika ion dalam keadaan gas bereaksi satu dengan yang lainnya membentuk senyawa kemudian melepaskan entalpi atau mengubah nilai entalpi, itulah disebut entalpi kisi. Misalnya pembentukan NACI yang biasanya melepaskan kalor ke lingkungan.
Na+(g)+Cl-(g)⇔NaCI(s)
Tabel Entalpi
Dibawah ini terdapat data nilai entalpi hidrokarbon umum:
| Nama | Rumus Kimia | Entalpi (Kkal/mol) |
| Hidrogen | H² | 0.0 |
| Asetilena | C2H2 | +54.2 |
| n-propana | C3H8 | -25.0 |
| n-butana | C4H10 | -30.0 |
| Metana | CH4 | -17.9 |
| Etana | C2H6 | -20.0 |
| n-pentana | C5H12 | -35.1 |
| n-heksana | C6H14 | -40.0 |
| n-heptana | C7H16 | -44.9 |
| n-oktana | C8H18 | -49.8 |
| n-nonana | C9H20 | -54.8 |
| n-dekana | C10H22 | -59.6 |
| 2-metil propana(Isobutana | C4H10 | -32.1 |
| 2,2-dimetipropana | C6H14 | -40.1 |
| 2-metilbutana(Isopentana) | C5H12 | -36.9 |
| 2,2 dimetibutana | C6H14 | -44.5 |
| 2-metilpentana(Isoheksana) | C6H14 | -41.8 |
Contoh Soal Entalpi
Tentukanlah nilai entalpi dari pembentukan standar H2CO3(l) ialah -125 kJ/mol. Bagaimana persamaan termokimia reaksi pembentukan zat tersebut?
Jawab:
Senyawa H2CO3 terbentuk dari unsur H,C dan Oberarti unsur pembentuknya ialah H2, C dan O2.
Maka persamaan termokimianya ialah:
H2(g) + C(s) + O2(g) → H2CO3ΔHf = -125kJ
Persamaan termokimia setelah disetarakan yakni sebagai berikut:
H2(g) + C(s) + 3/2O2(g) Ò H2CO3ΔHf = -62,5kJ
Contoh Soal Entalpi 2
Persamaan termokimia suatu zat ialah sebagai berikut:2C(s) + 8 H2 → 2C3H8(s)ΔH = – 225kJ/mol
Berapa besar entalpi pembentukan standar dari C3H8?
Jawab:
Terjadinya reaksi standar dalam pembentukan senyawa C3H8 yakni apabila mempunyai koefisien satu.
Maka akan diketahui pada pembentukan 2 mol C3H8 yang melepaskan kalor sebesar 225 kJ. Jadi agar dapat menemukan entalpi pembentukan 1 mol koefisien seluruh reaksi bisa di bagi 2.
Reaksi menjadi:
C(s) + 48 H2 → C3H8(s))Hf = – 112,5kJ/mol
Sehingga didapatkan besar entalpi pembentukan standar C3H8(s))Hf adalah – 112,5kJ/mol
Karena melepaskan kalor maka rekasnya termasuk reaksi eksoterm.
Nah itulah tadi materi pembahasan tentang entalpi, semoga artikel kali ini dapat bermanfaat bagi sobat semua.